Editora: Elisa Cristina Correia Mota
Colaboradoras: Ana Gabriella Tessarollo, Andressa de Oliveira Coiradas, Laíssa Mara Rodrigues Teixeira, Maria Eduarda Kostecki, Thais Yuri Miura.
Exigências para o crescimento microbiano[]
- Físicas: temperatura, pressão osmótica e pH adequados e água.
- Químicas: água, fontes de carbono e nitrogênio, minerais, oxigênio e fatores orgânicos do crescimento.
- Fatores orgânicos do crescimento: compostos essenciais que o organismo, incapaz de sintetizar, precisa captar do ambiente. Podem ser vitaminas, aminoácidos, purinas e pirimidinas. Organismos que necessitam de muitos fatores orgânicos do crescimento são fastidiosos (exigentes nutricionalmente).
Elementos químicos como nutrientes[]
- Carbono: base das moléculas orgânicas, corresponde a 50% do peso seco bacteriano.
- Nitrogênio: essencial aos aminoácidos. Corresponde a 14% do peso seco bacteriano.
- Enxofre: necessário à biossíntese de cisteína, cistina, metiotina e vitaminas (biotina e tiamina).
- Fósforo: essencial à síntese de ácidos nucleicos, ATP e fosfolipídios da membrana celular.
- Cálcio, potássio e magnésio: co-fatores para reações enzimáticas.
- Elementos traços: necessários em pequenas quantidades (ferro, cobre, zinco e molibdênio). São cofatores para atividade enzimática.
Classificação[]
Nutrição
- Qumioheterotróficos: organotróficos, obtêm a maior parte do carbono a partir de materiais orgânicos, que são fontes de energia da célula.
- Quimiolitotróficos: têm compostos inorgânicos como fontes de energia e dióxido de carbono como fonte de carbono.
- Quimioautotróficos: obtêm energia de fontes como o dióxido de carbono.
- Fotoautotróficos: luz é fonte de energia e dióxido de carbono é fonte de carbono.
Afinidade por oxigênio molecular[]
- Aeróbios: estritos (obrigatórios). Dependem do oxigênio molecular. São capazes de produzir mais energia a partir dos nutrientes que os anaeróbios. Pseudomonas, Acinetobacter.
- Anaeróbios facultativos: Não dependem do oxigênio molecular, mas são capazes de aproveitá-lo, quando disponível. Estão presentes na água e no trato intestinal humano. Enterobactérias, estreptococos, estafilococos, E. coli e muitas leveduras.
- Anaeróbios obrigatórios: Incapazes de aproveitar o oxigênio molecular. Para muitos deles, este é prejudicial. Nos humanos, esses microorganismos causam abscessos mais profundos e infecções de odor característico (butírico, rançoso). Clostridium tetani e Clostridium botulinum.
- Anaeróbios aerotolerantes: toleram a presença de oxigênio molecular, pois conseguem atenuar a toxicidade proveniente do contato com ele. Podem viver em superfícies.
- Microaerófilos: têm crescimento aeróbio, mas só sobrevivem em baixas concentrações de oxigênio molecular. Campylobacter, Clostridium gengivalis, Clostridium perfringens.
Afinidade por dióxido de carbono[]
- Capnofílicos são os microorganismos com crescimento ótimo em altas concentrações de dióxido de carbono.
Temperatura[]
A maioria dos microorganismos tem bom crescimento em temperaturas ideais para os humanos. A temperatura ótima de crescimento é aquela em que ocorre maior proliferação. Temperaturas máxima e mínima são os extremos em que o crescimento de um organismo é possível, mas menor que o da temperatura ótima. O intervalo entre temperaturas máxima e mínima de crescimento é de no máximo 30°C.
- Psicrófilos: Crescimento entre 0 e 20 °C. Temperatura ótima: 15°C.
- Psicrotróficos: Temperatura mínima é de 0°C. Temperatura ótima entre 20 e 30°C.
- Mesófilos: Os mais comuns. Têm crescimento entre 25 e 40°C. Os que habitam outros organismos normalmente têm temperatura ótima próxima à corporal de seu hospedeiro. Entre os mesófilos, estão a maioria dos microorganismos patogênicos e que degradam alimentos.
- Termófilos: Temperatura ótima entre 50 e 60°C. Muitos crescem em temperaturas menores que 45°C.
- Termófilos extremos ou hipertermófilos: são alguns dos membros do grupo archaea. Sua temperatura ótima é superior a 80°C..
Salinidade[]
Relacionada à pressão osmótica, cujo equilíbrio evita a perda de água pela célula ou a plasmólise.
- Halofílicas extremas ou obrigatórias: dependem de altas concentrações de sal para crescerem.
- Halofílicas facultativas: são mais comuns e independem de altas concentrações de sal. Crescem em conce sal (o que inibe o crescimento da maioria das outras bactérias). Poucas suportam concentração superior a 15%.
pH[]
A maioria das bactérias cresce dentro de pequenas variações, próximas à neutralidade (entre 6,5 e 7,5). Fungos têm maior tolerância às variações e seu pH ótimo varia entre 5 e 6. No meio de cultivo, o pH está geralmente entre 6,8 e 7,2 para favorecer o crescimento de bactérias patogênicas. Nem sempre o pH do meio de cultivo deve ser o mesmo do ambiente naturalmente colonizado. Bactérias podem produzir substâncias que alterem o pH do meio em que se encontram. Em laboratório, o efeito é contido por tampões.
- Acidófilas: crescem em pH < 5.
- Alcalófilas: crescem em pH > 5.
Crescimento das culturas bacterianas[]
Ocorre normalmente por fissão binária. Há brotamento em algumas espécies e reprodução por formação de cadeias de esporos nas bactérias filamentosas.
Tempo de geração[]
Tempo necessário para uma célula se dividir. É influenciado por condições ambientais.
http://www.uff.br/enzimo/index.php?option=com_content&view=article&id=17&Itemid=7
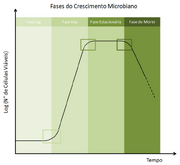
Fases de crescimento[]
Compões a curva de crescimento bacteriano, que demonstra o crescimento bacteriano em determinado período. É obtida quando se realiza a contagem da população em intervalos após o inóculo de pequena quantidade bacteriana em meio líquido.
- Fase lag: adaptação. Células em latência. Há pouca ou nenhuma divisão celular e alta atividade metabólica, especialmente a síntese de DNA e enzimas.
- Fase log: crescimento exponencial. Tempo de geração atinge valor constante e há alta sensibilidade a fatores ambientais. É a fase de maior metabolismo.
- Fase estacionária: diminuição na velocidade de crescimento. O número de bactérias geradas torna-se próximo ao de bactérias mortas. A população fica estável. As razões para o fim do crescimento exponencial não estão devidamente elucidadas.
- Fase de morte ou declínio: o núcleo
Quantificação do crescimento bacteriano[]
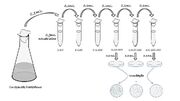
Diluição seriada (http://bacilosnasopa.files.wordpress.com/2012/08/tecnica-diluic3a7c3a3o-seriada.jpg)
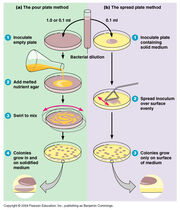
Incorporação (à esquerda) e espalhamento (à direita) (http://classes.midlandstech.edu/carterp/courses/bio225/chap06/Microbial%20Growth%20ss5.htm)
Processos relacionados[]
- Diluição seriada: o inóculo é diluído e parte dele é coletada, sendo novamente diluída. A diluição persiste até que o número de bactérias presente no inóculo seja "pequeno" o suficiente para permitir a contagem em placa. Após a contagem, pode-se estimar a quantidade de bactérias presentes no volume da amostra original.
- Espalhamento em placa: o inúculo é aplicada no ágar já solidificado, na placa de Petri.
- Pour plate (incorporação): o ágar ainda não solidificado é despejado sobre a diluição bacteriana, na placa de Petri.

Turbidimetria (http://enfo.agt.bme.hu/drupal/sites/default/files/turbidimetria.jpg)
Métodos[]
- Contagem em placa
- Filtração: usada na coleta de bactérias que estejam em pequena quantidade no meio líquido. O filtro tem poros pequenos o suficiente para impedir a passagem das bactérias. Após a passagem de 100 ml de líquido pelo filtro, este é transferido para a placa de Petri para a contagem.
- Número mais provável: usado para organismos incapazes de crescer em meio sólido. Parte do princípio de que, quanto mais diluições forem necessária para para eliminar o crescimento em tubos com o meio de cultura, maior a quantidade de bactérias na amostra.
- Contagem direta ao microscópio: o inóculo é espalhado pela lâmina. Corantes permitem que as bactérias sejam contadas e a quantidade de bactérias na amostra original é estimada.
- Turbidimetria: o espectofotômetro calcula a turbidez da amostra. Quanto mais turva a amostra, maior a quantidade de bactérias presentes. Para que a turbidimetria seja usada, o número de bactérias não pode ser inferior a 10 milhões por ml.
- Quantificação de um metabólito: quanto maior a quantidade do metabólito, maior a de bactérias.
- Peso seco: o melhor método para quantificar fungos. Estes são filtrados, desidratados, dessecados e pesados. Pode ser usado em bactérias, que podem ser obtidas do meio por centrifugação.
Meios de cultura[]
Materiais não nutrientes preparados em laboratório para o crescimento de microorganismos. Algumas bactérias não necessitam deles, outras não são capazes de crescer em nenhum dos meios já desenvolvidos. As bactérias que crescem em meios de cultura são denominadas culturas. O meio deve apresentar pH e quantidades de água e oxigênio adequados. Deve ser inicialmente estéril e, após receber as bactérias, incubado em temperatura adequada.
Conceitos[]
- Meio quimicamente definido: a composição química exata é conhecida.
- Meio complexo: tem componente proteico como fornecedor primário de carbono, nitrogênio, enxofre e energia. Quando administrado em forma líquida, é chamado caldo nutriente. Como as proteínas são maiores do que a maioria dos microorganismos pode aproveitar adequadamente, peptonas (pequenas cadeias de aminoácido, provenientes da digestão proteica) podem ser fornecidas às bactérias.
- Meio redutor: contém reagentes que se ligam ao oxigênio dissolvido e o eliminam do meio de cultura. É usado para microorganismos anaeróbios.
- Meio seletivo: favorece o crescimento de determinada bactéria e inibe o de outra.
- Meio diferencial: permite a identificação da bactéria de interesse quando há mais de um tipo na placa.
- Meio de enriquecimento: sua adição favorece o crescimento de uma bactéria em relação às demais, que estão em maior quantidade. É considerado um meio seletivo.
Tipos[]
1. Ágar-ágar: polissacarídeo (éster de sulfato de galactana, extraído de algas Gelidum) com consistência sólida. Poucos microorganismos são capazes de degradá-lo. Nutrientes devem ser adicionados ao meio. É adicionado ao tubo ou placa antes de sua solidificação. Não pode ser usado para anaeróbios.
- Meio líquido (tubo): não contém ágar.
- Meio sólido: frequentemente 1,5% de ágar. Um aumento na concentração pode elevar a pressão osmótica e inibir o crescimento bacteriano. A bactéria cresce somente na superfície. Quando usado no tubo, pode solidificar-se em posição íngreme (ágar inclinado) ou na posição vertical (ágar em coluna)²
- Meio semi-sólido (tubo): 0,25% de ágar.

Ágar sangue: estreptococos alfa e beta hemolíticos.(http://inst.bact.wisc.edu/inst/index.php?module=book&func=displayarticle&art_id=137)
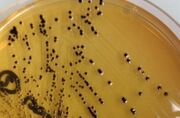
Salmonella no Ágar SS (http://www.retroscope.eu/wordpress/salmonella-spp/salmonellassagar/)
3. Ágar chocolate: ágar junto ao sangue fervido (desnaturado). Tem maior disponibilidade de aminoácidos que o ágar sangue e é usado para bactérias fastidiosas, como pneumococos. Não é seletivo e seu nome é derivado da coloração que apresenta.
4. Ágar Thayer Martin: seletivo e específico para Neisseria (gonorrhoeae e meningiditis), pois contém antibióticos que inibem outras bactérias: vancomicina e colistina, além de nistatina (ação antifúngica).
5. Ágar SS: altamente seletivo, é usado apenas para Salmonella e Shigella. Só a Salmonella metaboliza enxofre e deixa pontos pretos no ágar SS.
6. Mac Conkey: seletivo para bacilos gram negativos, por conter sais biliares e cristal violeta. Diferencial quanto à fermentação da lactose, que promove a formação de ácido pirúvico, alterando o pH do meio. As colônias formadas são róseas e as bactérias fermentadoras são denominadas lactose positivas. Bactérias que não fermentam a lactose (lactose negativas) utilizam peptona e formam amônia, elevando o pH do meio. Colônias formadas
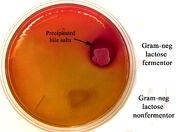
MacConckey (http://www.marietta.edu/~spilatrs/biol202/labresults/macconkey.html)
são incolores. Essa diferenciação é importante na identificação da Salmonella patogênica.
7. CLED: não seletivo. Usado em uroculturas. É diferencial quanto ao processamento da lactose: bactérias não fermentadoras formam colônias azuis, enquanto as fermentadoras formam as amarelas.
8. Ágar Muller Hinton³: Oferece condições de crescimento às principais bactérias. É usado na avaliação da resistência aos principais antimicrobianos (antibiograma) pelos métodos de difusão em disco e E-test (determinação de cepas susceptíveis ou não à ação de determinado antibiótico) para Staphylococcus e Enterococcus. Não é seletivo, nem diferencial.

Meios de transporte e conservação
- Caldo selenito: possui mix de nutrientes (pectona, dextrose e outros) e mantém a bactéria viável até que chegue ao laboratório. É usado para coleta em UTI neonatal.
- Meio de Stuart: "universal". Semi-sólido usado para a maioria dos materiais clínicos. Evita a replicação bacteriana, apesar se permitir sua sobrevivência.
Referências bibliográficas[]
1. TORTORA, G.J.; FUNKE B.R.; CASE C.L. Microbiologia. 6ª ed. Porto Alegre. Ed. Artmed, 2000.
2. MOTA, E.C.C. Anotações da aula da disciplina de Microbiologia e Parasitologia. UNIVILLE. 07/03/13.
3. Descrição dos Meios de Cultura Empregados nos Exames Microbiológicos. Módulo IV. Agência Nacional de Vigilância Sanitária.
Links relacionados[]
Descrição dos meios de cultura empregados nos exames microbiológicos