Editor: Amanda Lewandowski da Silva
Colaboradores: Giovani Meneguzzi de Carvalho, Lisiane Martins, João Francisco Petry, Mariana Ribeiro e Silva e Pâmella Kreling
Receptores para ação de fármacos,[]
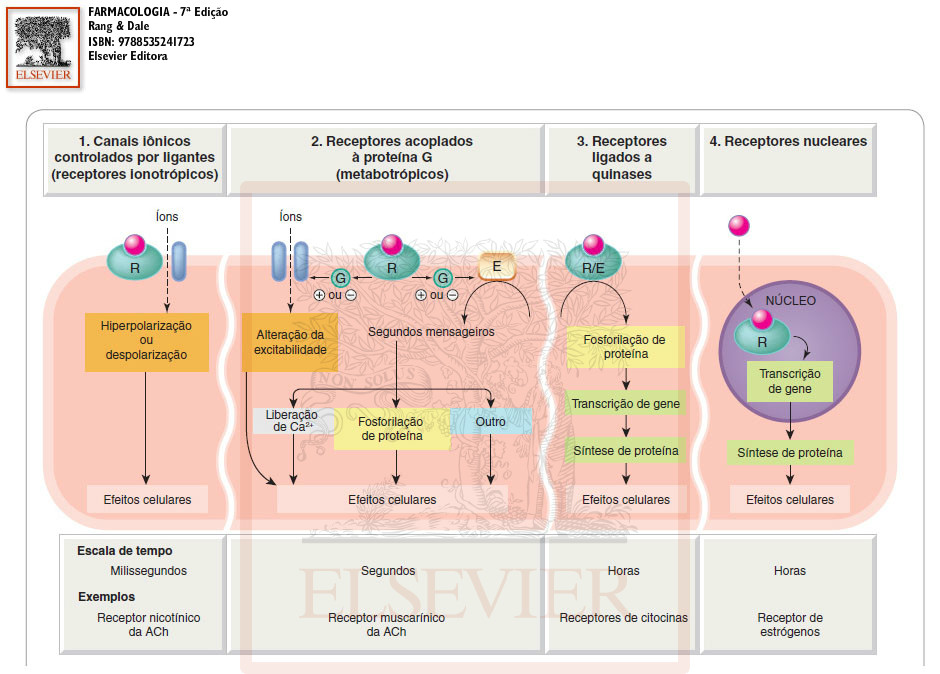
Relação entre os quatro tipos de receptores com os respectivos efetores, escala de tempo e exemplos. Farmacologia, Rang & Dale, 7ª edução.
Receptor tipo I ou ionotrópico
Também chamados de receptores ionotrópicos por estarem associados a canais iônicos dependentes de ligantes. São proteínas transmembrana e são responsáveis por alterar a composição iônica e o potencial da membrana.
Os íons Na serão os principais causadores da despolarização e os íons Cl, da repolarização e hiperpolarização.
Neurotransmissores rápidos irão atuar nesse tipo específico de receptor.
Exemplo: receptores que possuem ação de abertura dos canais para a entrada de íons:
- Receptor nicotínico da acetilcolina (de caráter imediato)
- Receptor de GABAa
- Receptor de glicina
- Alguns receptores de glutamato: NMDA, AMPA e CAINATO.
Os receptores tipo I são ativados a partir da fosforilação dos canais iônicos por proteinocinases intracelulares. Essas proteinocinases serão ativadas pelos receptores tipo II.
-Estrutura molecular dos receptores I:
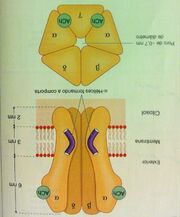
Estrutura do receptor nicotínico de acetilcolina (um típico canal iônico controlado por ligante).
Ex: receptor nicotínico da acetilcolina:
Possui estrutura pentamérica, com uma estrutura beta, uma delta e uma gama (com funções conformacionais) e duas estruturas alfa (que possuem os sítios de ligação). Por existirem duas estruturas alfa, serão necessárias duas moléculas de acetilcolina para ativar o canal iônico, que irá transportar o Na do meio extra para o meio intracelular, causando a despolarização da musculatura esquelética.
Receptor tipo II ou metabotrópico ou acoplado à proteína G[]
Receptores que contêm sete α hélices transmembrana (hepta-helicoidal) com um domínio N-terminal extracelular e um domínio C terminal intracelular. A proteína G se liga no domínio intracelular e vai atuar no sistema efetor (proteínas efetoras) que podem ser enzimas ou canais iônicos. A proteína G, portanto, é responsável em propagar a informação veiculada pela substância que se ligou ao domínio extracelular.
Exemplos de receptores metabotrópicos:
· Receptores hormonais
· Receptores muscarínicos da acetilcolina (lentos) *
· Receptores adrenérgicos
· Receptores opioides
· Recep
A ação desses receptores é lenta porque necessitam de mensageiros (proteína G) para propagar a informação.
Proteína G
São proteínas ancoradas á membrana interna que atuam como transdutores celulares reconhecendo o receptor tipo II e enviando a informação ao alvo final. É formada por três subunidades (α, β e γ).
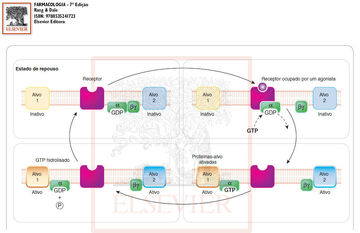
Função da proteína G. Farmacologia, Rang & Dale. 7ª edição.
Acompanhe a imagem: No estado de repouso a proteína G aparece como um trímero αβγ não ligado ao receptor e o GDP ligado à subunidade α. Quando uma molécula agonista se liga ao receptor, este se torna ativado, além disso, o receptor sofre uma mudança conformacional no seu lado citoplasmático, aumentando a afinidade pelo αβγ. Portanto, quando o trímero se liga ao receptor a molécula de GDP é substituída pelo GTP e, desse modo, ocorre dissociação do trímero da proteína G. A α-GTP e a βγ se difundem na membrana e ativam proteínas efetoras (alvos), que, nesse caso, são canais iônicos. As associações de α e βγ com as proteínas alvo pode causar ativação ou inibição do canal e, assim, regulando o transporte de íons.
Quando a subunidade α exerce a atividade de GTPase há hidrólise do GTP que estava associado ao α, gerando GDP e liberando fosfato. O α-GDP resultante se dissocia do efetor e religa ao βγ, que também se dissociou da proteína efetora, e assim, completa-se o ciclo. A ligação da subunidade α com uma molécula efetora serve para aumentar a atividade da GTPase de α.
Principais subtipos de proteínas G e suas funções (válido tanto para α quanto para βγ)
· Gs: atua em enzimas, como a adenilil ciclase (ou adenilato ciclase), estimulando e, nesse caso, levando a formação de AMPc.
· Gi: atua inibindo a adenilil ciclase, diminuindo a formação de AMPc.
· Go: atua ativando canal de K+, entretanto, essa atividade deve-se principalmente ás subunidades βγ.
· Gq: ativa a fosfolipase C, aumentando a produção dos segundos mensageiros (inositol trifosfato e diacilglicerol).
Alvos da proteína G Mensageiros
Adenilil ciclase ---------- AMPc
Fosfolipase C ----------- Inositol trifosfato (IP3) e diacilglicerol
Canais iônicos ----------- K+ e Ca2+
AMPc (3’, 5’ – adenosina monofosfato cíclico)
==[]
É um nucleotídeo cíclico formado no interior da célula a partir do ATP, pela ação da enzima adenilil ciclase. O AMPc é produzido continuamente e inativado pelas enzimas fosfodiesterases, as quais hidrolisam o AMPc, gerando 5’-AMP. Outra forma de finalizar a ação do AMPc é através de uma proteína transmembrana que transporta o AMPc do meio intracelular para o extracelular.
Funções do AMPc
· Regulação de enzimas envolvidas no metabolismo energético
· Regulação de divisão e diferenciação celular
· Regulação do transporte de íons
· Regulação dos canais iônicos
· Regulação das proteínas contráteis no músculo liso
Esses efeitos variados são efetuados pela ativação de proteínas quinases pelo AMPc.
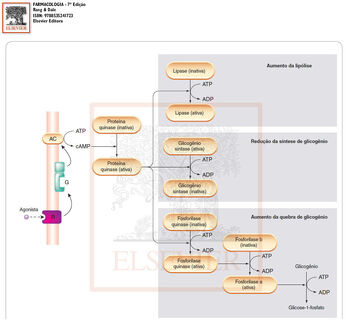
Regulação do metabolismo energético pelo AMPc. Farmacologia, Rang & Dale. 7ª edição.
Acompanhe a imagem: A proteína quinase A fosforila a lipase, ativando-a, fosforila o glicogênio sintase A, inativando-o e fosforila a fosforilase quinase, ativando-a. A fosforilação consiste na adição de fosfato proveniente da ATP na enzima desejada. No final do processo, a glicose-1-fosfato formada servirá para produzir energia na forma de ATP.
No músculo cardíaco, por exemplo, há adição de fosfato pela proteína quinase A no canal de Ca2+ (fosforilação dos canais de Ca2), desse modo, aumentando a entrada do íon na célula e aumentando a contração cardíaca.
Fosfolipase C
Ativado pela proteína Gq, atua na síntese de segundos mensageiros. Fosfatidilinositol 4,5 difosfato (PIP2), um fosfolipídeo na membrana da célula é transformado em diacilglicerol + inositol 1,4,5 trifosfato (segundos mensageiros) pela atuação da fosfolipase C.
Por exemplo, o receptor metabotrópico α1 norepinefrina ativa a proteína Gq, que, consequentemente, vai ativar a fosfolipase C a produzir mensageiros.
Inositol 1,4,5 trifosfato (IP3)
É um mediador hidrossolúvel (polar) liberado da membrana para atuar no citoplasma, mais precisamente, no receptor específico IP3, o qual é um canal de cálcio controlado por ligante que está presente na membrana dos retículos endoplasmáticos. Portanto, a função do inositol trifosfato é de controlar a liberação de cálcio das reservas intracelulares (retículo endoplasmático) para o citosol.
O íon cálcio, por sua vez, pode ter a função de controlar canais iônicos, como por exemplo, os canais de K+ sensíveis ao Ca2+. Pode atuar, também, ligando-se a calmodulina (regula a atividade de enzimas). A calmodulina mais o cálcio ativam miosina quinase, a qual irá fosforilar a miosina, assim, miosina se liga a actina, levando a contração do músculo liso. Portanto, calmodulina ativa proteinocinases.
Diacilglicerol (DAG)
É altamente lipofílico e continua ancorado à membrana. Atua ativando a proteína quinase C (PKC), a qual é responsável por fosforilar outras proteínas intracelulares, aumentando ou diminuindo a ação dessas proteínas. O diacilglicerol efetua também a ligação de proteínas com domínios ricos em cisteína, esses domínios regulam a liberação de neutransmissores.
Canais iônicos como alvos das proteínas G
Receptores acoplados á proteína G podem controlar canais iônicos sem necessitar de segundos mensageiros, como AMPc e fosfatos de inositol. Esse efeito é mais rápido e direto quando comparado com sistemas enzimáticos e mais lento que receptor ionotrópico. Como exemplo, se tem o receptor muscarínico da acetilcolina no músculo cardíaco. Esse receptor atua em proteína Go aumentando a permeabilidade do canal aos íons potássio e, assim, causando hiperpolarização. Isso deixará a célula mais lenta e diminuirá a frequência cardíaca.
Receptor tipo III ou proteinocinase
São receptores ligados a quinases. É composto de uma cadeia com até mil resíduos. O domínio extracelular é ligado por uma α hélice ao domínio intracelular, e este possui atividade enzimática. Esses receptores estão relacionados às ações de fatores de crescimento, citocinas e hormônios como a insulina, cujos efeitos são realizados, principalmente, em nível de transcrição gênica.
As proteinocinases têm como função fosforilar proteínas efetoras intracelulares e, como resultado há alterações na atividade bioquímica das proteínas, já que receberam fosfato, e interações entre outras proteínas.

O fator de crescimento se liga ao receptor tipo III e ocorre então, dimerização do complexo receptor e ligante. A seguir, há autofosforilação da tirosina (o resíduo de tirosina recebe molécula de fosfato), então, uma proteína com domínio SH2 se liga ao receptor fosforilado e acabam se fosforilando também. Ocorre ativação de Ras e início da cascatas das quinases, culminando em formação de vários fatores de transcrição e finalmente, em transcrição gênica. Farmacologia, Rang & Dale. 7ª edição.
Principais tipos de receptores tipo III
· Receptores tirosina quinase (RTKs) incorporam uma porção de tirosina quinase na região intracelular desse receptor. Fosforilam proteínas que tenham resíduos de tirosina. Os receptores de insulina são RTKs, assim como os receptores para fator de crescimento epidérmico e neural.
· Receptores de serina/treonina quinases fosforilam resíduos de serina e/ou treonina. Exemplo: fator de transformação de crescimento.
· Receptores de citocinas não possuem atividade enzimática intrínseca. Atuam ativando proteinoquinases citosólicas. Exemplo: receptores de citocinas, fatores estimuladores de colônias e hormônios do crescimento.
· Receptores associados à guanilil ciclase: a porção enzimática é guanilil ciclase, e regula a formação de GMPc através da hidrólise de GTP.
Mecanismo da fosforilação:
Fosforilação = quinases = adição de fosfato
Desfosforilação =fosfatases = retirada de fosfato
Receptor tipo IV ou nucleares[]
São fatores para produção de RNA (de transcrição) ativados por ligantes. Estão presentes no citoplasma ligados a proteínas e, portanto, inativos. Quando um ligante, por exemplo, um hormônio se encaixa no receptor, este se desprende da proteína e migra para o núcleo, tornando-se agora ativo.
Em relação a estrutura do receptor, possui um domínio N-terminal que regula a transcrição do DNA, um domínio de ligação para o DNA no centro da estrutura e um domínio C-terminal que contém o módulo de ligação ao ligantes e é específico para cada classe de receptor.
Exemplos de receptor tipo IV:
· Receptores para hormônios esteroides
· Receptores para hormônios da tireoide
· Receptores para vitaminas D e A (ácido retinóico)
Classificação dos receptores nucleares
Classe I: receptores para hormônios esteróides.
Classe II: receptores para lipídeos. Por exemplo o receptor ativador de proliferação de peroxissomo, que sintetiza enzimas para regular o perfil lipídico, e assim retirar VLDL do sangue e contribuir na formação do bom colesterol.
Classe III: é um subgrupo da classe II que atua na sinalização endócrina. Por exemplo o receptor para hormônios da tireoide e da vitamina D.

Estrutura geral de quatro famílias de receptores. Farmacologia Rang & Dale. 7ª edição.
Referências bibliográficas:
1. RANG, H. P.; DALE, M. M. Rang & Dale. Farmacologia. 7. ed. Rio de Janeiro: Elsevier, 2011.
2. SILVA, AL. Anotações em sala de aula a partir da aula ministrada pela professora Daniela Dewling de Lima.
3. GOODMAN, L.S; GILMAN, A. (eds.). As Bases Farmacológicas da Terapêutica. 12. Ed. Porto Alegre: Editora McGraw Hill, 2012.
Links externos:
1. G-Protein Receptor Activation - http://www.youtube.com/watch?v=xT0mAQ4726s&hd=1
2. Second Messenger System: cAMP - http://www.youtube.com/watch?v=Y2er_Dfgg44&hd=1
3. G Protein Cycle - http://www.youtube.com/watch?v=nQfaTvV9D5s&hd=1